España autoriza el ensayo en fase III de la vacuna de Johnson & Johnson
El ensayo en fase III de la vacuna de Johnson & Johnson constará de dos dosis y se llevará a cabo en nueve centros hospitalarios españoles
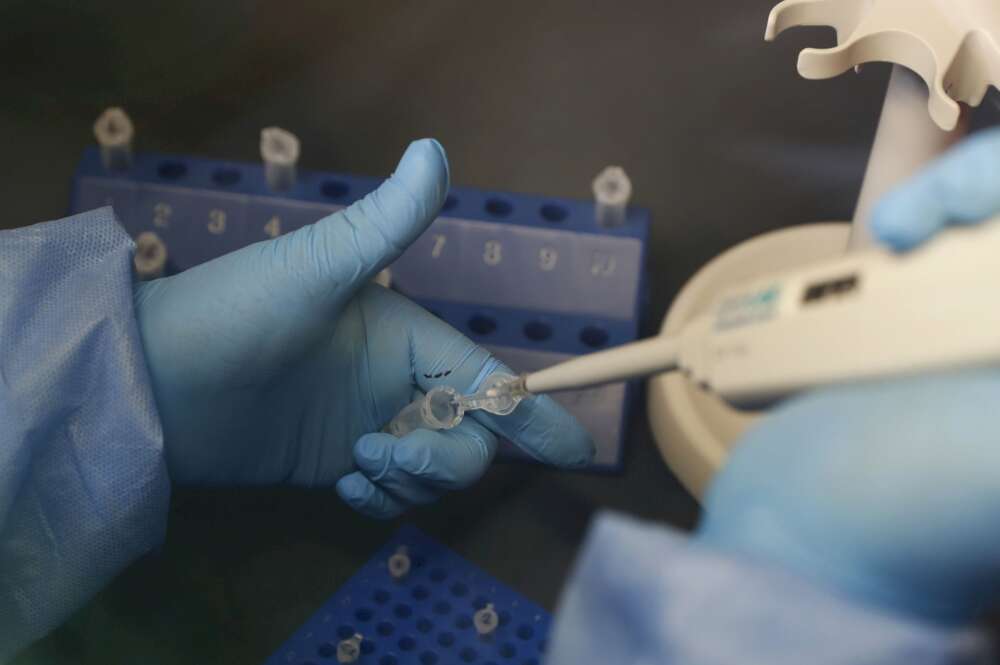
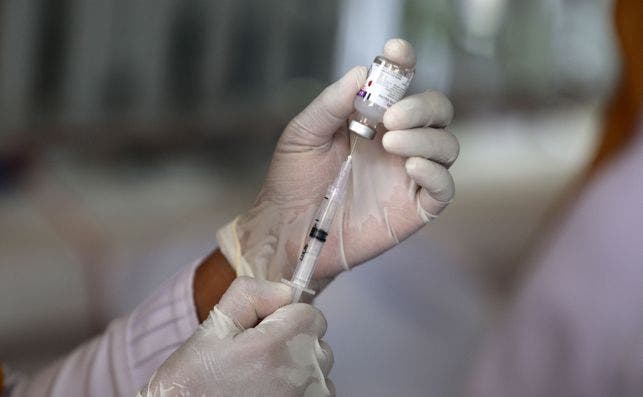
Por primera vez España va a ser el escenario de un ensayo clínico en etapa tardía de una vacuna contra el coronavirus. La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) ha autorizado llevar a cabo la fase III del prototipo que desarrolla Johnson & Johnson. Así, España se convierte en uno de los ocho países en los que se evaluará la eficacia y seguridad de este remedio en alrededor de 30.000 voluntarios.
El ensayo constará de dos dosis de vacuna y se llevará a cabo en nueve centros hospitalarios que iniciarán, tan pronto como sea posible, el reclutamiento de voluntarios que cumplan con los criterios de inclusión especificados en su protocolo. Inicialmente, recibirán la inyección los participantes sin enfermedades concomitantes que se asocian a un mayor riesgo de progresión hacia un covid grave.
Según ha informado el Ministerio de Sanidad, se trata de un ensayo multinacional. Es decir, se administra la vacuna o un placebo enmascarado de manera que se impida su identificación a simple vista.
El 30% de los participantes serán mayores de 60 años
Tras la evaluación por parte de un comité independiente de vigilancia de los datos de seguridad de estos participantes, se pasará eventualmente a incluir a voluntarios con enfermedades concomitantes que sí se asocian a un mayor riesgo de progresión a covid grave, según ha informado el departamento que dirige Salvador Illa. Un 20% de los pacientes serán menores de 40 años, y un 30% mayores de 60.
Durante todo ensayo se llevará a cabo una monitorización estrecha de todos los voluntarios y una identificación de todos los casos. El Ministerio ha recordado que «sólo tras el análisis de los datos por las autoridades regulatorias competentes, y una evaluación favorable del balance beneficio-riesgo, se autorizaría la comercialización en territorio europeo».
Esta vacuna, denominada Ad26.COV2.S, está basada en un tecnología sólidamente documentada con un adenovirus recombinante no replicativo, para generar una respuesta inmunológica frente a una de las proteínas del coronavirus conocida como proteína S –de spike, también llamada proteína espiga en español–.
El inicio de los ensayos clínicos es, según el Gobierno, un hito más en este camino que deberá terminar con la eventual autorización y puesta a disposición de la ciudadanía de vacunas eficaces y seguras. El Ministerio de Sanidad, a través de la AEMPS, mantiene contacto con diferentes compañías que han propuesto la inclusión de centros españoles en sus ensayos clínicos para contribuir al esfuerzo global en la búsqueda de la vacuna contra la Covid-19.
Revés por una enfermedad «inexplicable»
Hace un mes Johnson & Johnson paralizó los ensayos después de que uno de los voluntarios sufriera una «enfermedad inexplicable. «Siguiendo nuestras pautas, la enfermedad del participante está siendo revisada y evaluada por la Junta de Monitoreo de Seguridad de Datos (DSMB) independiente de ENSEMBLE (nombre de la investigación), así como por nuestros médicos internos clínicos y de seguridad», aseguró la compañía en un comunicado.
No obstante, este tipo de incidente es muy común especialmente en grandes estudios. Tras comprobar que era seguro, la farmacéutica continuó las pruebas en busca del antídoto contra el coronavirus. Además, como los voluntarios también reciben placebo en gran medida, “no siempre es evidente de inmediato si participante recibió un tratamiento de estudio o un placebo”, insistió la firma.